BELAJAR TATA NAMA SENYAWA KOMPLEKS
TATA NAMA SENYAWA
KOMPLEKS
KOMPLEKS
Tata cara
penamaan senyawa kompleks antara lain dipublikasikan oleh IUPAC dalam Nomenclature of Inorganic Chemistry (
Blackwell Scientific Publisher, 1989).
penamaan senyawa kompleks antara lain dipublikasikan oleh IUPAC dalam Nomenclature of Inorganic Chemistry (
Blackwell Scientific Publisher, 1989).
Beberapa aturan
dasar dalam penamaan senyawa kompleks dijelaskan berikut ini.
dasar dalam penamaan senyawa kompleks dijelaskan berikut ini.
PENULISAN NAMA SENYAWA KOMPLEKS
Dalam menuliskan nama dari suatu
senyawa kompleks, beberapa aturan dasar adalah sebagai berikut :
senyawa kompleks, beberapa aturan dasar adalah sebagai berikut :
1.
Nama ion positif dalam senyawa kompleks dituliskan di
awal, diikuti nama ion negatif
Nama ion positif dalam senyawa kompleks dituliskan di
awal, diikuti nama ion negatif
2.
Untuk menuliskan nama ion kompleks, nama ligan
dituliskan pertama dan diurutkan secara alfabetis (tanpa memandang jenis
muatannya), diikuti oleh nama logam
Untuk menuliskan nama ion kompleks, nama ligan
dituliskan pertama dan diurutkan secara alfabetis (tanpa memandang jenis
muatannya), diikuti oleh nama logam
Contoh
:
:
v [CoSO4(NH3)4]NO3
tetraamminsulfatkobalt
(III) nitrat
(III) nitrat
v K4[Fe(CN)6]
kalium heksasianoferat
(II)
(II)
3.
Jika dalam senyawa kompleks ada sejumlah ligan yang
sama, biasanya digunakan awalan di, tri, tetra,
penta, heksa, dan seterusnya untuk menunjukkan jumlah ligan dari jenis
itu. Suatu pengecualian terjadi jika nama dari suatu ligan mengandung suatu
angka, misalnya dipiridil atau etilendiamin.
Untuk menghindari kerancuan dalam kasus semacam itu, digunakan awalan bis, tris,
dan tetrakis sebgai ganti di, tri,
dan tetra, dan nama dari ligan
ditempatkan dalam tanda kurung.
Jika dalam senyawa kompleks ada sejumlah ligan yang
sama, biasanya digunakan awalan di, tri, tetra,
penta, heksa, dan seterusnya untuk menunjukkan jumlah ligan dari jenis
itu. Suatu pengecualian terjadi jika nama dari suatu ligan mengandung suatu
angka, misalnya dipiridil atau etilendiamin.
Untuk menghindari kerancuan dalam kasus semacam itu, digunakan awalan bis, tris,
dan tetrakis sebgai ganti di, tri,
dan tetra, dan nama dari ligan
ditempatkan dalam tanda kurung.
Contoh
:
:
v [Co(en)3]2(SO4)3
Tris(etilendiammin)kobalt(III)
sulfat
sulfat
v [Co(en)2(ONO)Cl]Cl
Bis(etilendiammin)nitritokobalt(III)
klorida
klorida
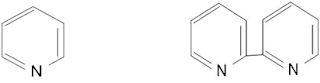
Contoh lain :
 Senyawa [Cu(py)2Cl2], (py adalah ligan piridin), tidak
Senyawa [Cu(py)2Cl2], (py adalah ligan piridin), tidakdinamakan sebagai diklorodipiridintembaga
(II). Kompleks tersebut dinamakan sebagai kompleks diklorobis(piridin)tembaga(II). Penamaan tersebut
dikarenakan kompleks mengandung 2 ligan piridin, bukan 1 ligan dipiridin.

(a)
(b)
(b)
Gambar a. ligan piridin
Gambar b. ligan dipiridin
Aturan Penulisan
Nama Ligan
Nama Ligan
(a)
Nama dari ligan yang bermuatan negatif beri akhiran –o, contohnya:
Nama dari ligan yang bermuatan negatif beri akhiran –o, contohnya:
|
F– fluoro
Cl– kloro
Br– bromo
I– iodo
|
H– hidrida
OH– hidrokso
O2- okso
O2-2 perokso
|
HS– merkapto
S2- thio
CN– siano
NO2– nitro
|
(b)
Ligan yang tidak bermuatan atau netral tidak diberi
akhiran khusus. Contohnya meliputi NH3 (amina), H2O (akua),
CO (karbonil) dan NO (nitrosil). Ligan N2 dan O2 disebut
dinitrogen dan dioksigen. Ligan organik biasanya disebut dengan nama lazimnya,
contohnya fenil, metil, etilendiamin, piridin, trifenilfosfin
Ligan yang tidak bermuatan atau netral tidak diberi
akhiran khusus. Contohnya meliputi NH3 (amina), H2O (akua),
CO (karbonil) dan NO (nitrosil). Ligan N2 dan O2 disebut
dinitrogen dan dioksigen. Ligan organik biasanya disebut dengan nama lazimnya,
contohnya fenil, metil, etilendiamin, piridin, trifenilfosfin
(c)
Walaupun jarang ada, ligan yang bermuatan positif diberi
akhiran –ium, misalnya NH2NH3+
(hidrazinium)
Walaupun jarang ada, ligan yang bermuatan positif diberi
akhiran –ium, misalnya NH2NH3+
(hidrazinium)
Beberapa
ligan yang cukup rumit strukturnya atau memiliki nama yang cukup panjang dapat
dituliskan dengan menggunakan singkatan tertentu. Beberapa nama ligan yang
umumnya disingkat dapat dilihat dalam tabel berikut.
ligan yang cukup rumit strukturnya atau memiliki nama yang cukup panjang dapat
dituliskan dengan menggunakan singkatan tertentu. Beberapa nama ligan yang
umumnya disingkat dapat dilihat dalam tabel berikut.
|
Nama ligan
|
Simbol/singkatan
|
|
n Etilendiamin
n Piridin
n Propilendiammin
n Dietilendiammin
n Trietilendiammin
n Bipiridin
n Etilendiamintetraasetat
n Dimetilglioksimat
n fenantrolin
|
en
py
pn
dien
trien
bipy
EDTA
DMG
Phen
|
Aturan Penulisan
Nama Logam
Nama Logam
a.
Nama logam pusat dalam ion kompleks dituliskan paling
akhir
Nama logam pusat dalam ion kompleks dituliskan paling
akhir
b.
Logam pada kompleks negatif (anion) diberi akhiran –at
Logam pada kompleks negatif (anion) diberi akhiran –at
Contoh : Na[Co(CO)4] = natrium
tetrakarbonilkobaltat (I)
tetrakarbonilkobaltat (I)
c.
Logam pada kompleks netral atau kompleks positif
(kation) tidak diberi akhiran khusus
Logam pada kompleks netral atau kompleks positif
(kation) tidak diberi akhiran khusus
Contoh :
[Co(NO2)3(NH3)3]
= Triammindinitrokobalt(III)
= Triammindinitrokobalt(III)
[CoSO4(NH3)4]NO3
= Tetraamminsulfatokobalt(III)
= Tetraamminsulfatokobalt(III)
d.
Muatan dari logam pusat ditunjukkan dengan angka
Romawi yang langsung dituliskan di belakang nama logam tersebut
Muatan dari logam pusat ditunjukkan dengan angka
Romawi yang langsung dituliskan di belakang nama logam tersebut
PENULISAN
RUMUS MOLEKUL SENYAWA KOMPLEKS
RUMUS MOLEKUL SENYAWA KOMPLEKS
Dalam menuliskan
rumus molekul senyawa kompleks, ada beberapa aturan yang harus iikuti, yaitu
sebagai berikut :
rumus molekul senyawa kompleks, ada beberapa aturan yang harus iikuti, yaitu
sebagai berikut :
1.
Ion kompleks dituliskan dalam tanda kurung
persegi “ […..]”
Ion kompleks dituliskan dalam tanda kurung
persegi “ […..]”
2.
Logam dituliskan pertama, diikuti ligan
Logam dituliskan pertama, diikuti ligan
3.
Ligan dituliskan setelah logam dengan urutan :
Ligan dituliskan setelah logam dengan urutan :
ligan negatif – ligan netral – ligan positif
4.
Urutan penulisan ligan dengan muatan yang sama disesuaikan dengan urutan abjad
Urutan penulisan ligan dengan muatan yang sama disesuaikan dengan urutan abjad
Contoh :
v triammintrinitrokobalt (III) = [Co(NO2)3(NH3)3]
v kalium nitrosilpentasianoferat(II) = K[Fe(CN)5NO]
LIGAN AMBIDENTAT
Beberapa jenis
ligan memiliki lebih dari satu pasang elektron bebas yang bisa digunakan dalam
pembentukan ikatan, sehingga dapat terikat pada logam melalui atom yang berbeda.
Ligan semacam ini disebut sebagai ligan ambidentat.
ligan memiliki lebih dari satu pasang elektron bebas yang bisa digunakan dalam
pembentukan ikatan, sehingga dapat terikat pada logam melalui atom yang berbeda.
Ligan semacam ini disebut sebagai ligan ambidentat.
Contoh :
v NO2–
: nitro ONO– :
nitrito
: nitro ONO– :
nitrito
Ligan nitro berikatan dengan logam melalui
pasangan elektron bebas pada atom N. Adapun
ligan nitrito berikatan dengan logam melalui psangan elektron bebas yang
dimiliki oleh atom O
pasangan elektron bebas pada atom N. Adapun
ligan nitrito berikatan dengan logam melalui psangan elektron bebas yang
dimiliki oleh atom O
v SCN–
: tiosianato NCS– :
isotiosiano
: tiosianato NCS– :
isotiosiano
Tiosianat
terikat pada logam melalui atom S. Sedangkan
isotiosianta membentuk ikatan dengan logam melalui pasangan elektron bebas yang
dimiliki oleh atom N
terikat pada logam melalui atom S. Sedangkan
isotiosianta membentuk ikatan dengan logam melalui pasangan elektron bebas yang
dimiliki oleh atom N
Atom pada ligan
yang berikatan dengan logam dapat pula ditunjukkan dengan menuliskannya dalam huruf
kapital
yang berikatan dengan logam dapat pula ditunjukkan dengan menuliskannya dalam huruf
kapital
Contoh :
v [Co(NH3)5(NO2)]Cl2 (kuning-kecoklatan)
Pentaamminnitrokobalt(III) klorida
pentaamminnitrito-N-kobalt(III) klorida
v [Co(NH3)5(ONO)]Cl2 (merah)
Pentaamminnitritokobalt(III) klorida
Pentaamminnitrito-O-kobalt(III) klorida
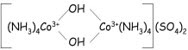
LIGAN JEMBATAN
Pada
sejumlah kompleks, terdapat lebih dari satu atom logam sebagai atom pusat dari
kompleks tersebut. Kedua atom logam dihubungkan oleh ligan yang berfungsi
sebagai jembatan dengan menghubungkan 2 atom logam tersebut. Ligan semacam ini
disebut sebagai ligan jembatan
sejumlah kompleks, terdapat lebih dari satu atom logam sebagai atom pusat dari
kompleks tersebut. Kedua atom logam dihubungkan oleh ligan yang berfungsi
sebagai jembatan dengan menghubungkan 2 atom logam tersebut. Ligan semacam ini
disebut sebagai ligan jembatan
Ligan yang
berfungsi sebagai ligan jembatan pada penulisannya diberi awalan μ. Jika ada dua
atau lebih ligan jembatan, dinyatakan sebagai di-μ atau μ-di,tri-μ atau μ-tri, dan seterusnya
berfungsi sebagai ligan jembatan pada penulisannya diberi awalan μ. Jika ada dua
atau lebih ligan jembatan, dinyatakan sebagai di-μ atau μ-di,tri-μ atau μ-tri, dan seterusnya
Urutan ligan
jembatan dalam penulisan nama kompleks disesuaikan secara alfabetis dengan
ligan-ligan lainnya dalam kompleks tersebut
jembatan dalam penulisan nama kompleks disesuaikan secara alfabetis dengan
ligan-ligan lainnya dalam kompleks tersebut
 Contoh :
Contoh :
Oktaammine μ-dihidroksodikobalt(III)
sulfat
sulfat
LATIHAN
1.
Berikan nama bagi sejumlah senyawa kompleks berikut !
Berikan nama bagi sejumlah senyawa kompleks berikut !
a.
Na2[Fe(CN)5(NO)]
Na2[Fe(CN)5(NO)]
b.
[Co(N3)(NH3)5]SO4
[Co(N3)(NH3)5]SO4
c.
K2[Cr(CN)2(O)2(O2)(NH3)]
K2[Cr(CN)2(O)2(O2)(NH3)]
d.
[Pt(NH3)4Cl2][PtCl4]
[Pt(NH3)4Cl2][PtCl4]
e.
K4[Ni(CN)4]
K4[Ni(CN)4]
2.
Tuliskan rumus bagi senyawa kompleks yang memiliki
nama berikut !
Tuliskan rumus bagi senyawa kompleks yang memiliki
nama berikut !
- Diklorotetraakuokromium (III) nitrat
- Kalium tetrafluoroargentat (I)
- Kalium tetraazidokobaltat (III)
- Amonium akuopentafluoronikelat (IV)
- Diammin perak (I) tetrasianoferrat (III)
- Oktaamin-